n-butylamin
| n-Butylamin | |
|---|---|
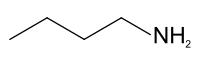 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | butan-1-amin |
| Funkční vzorec | CH3(CH2)3NH2 |
| Sumární vzorec | C4H11N |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 109-73-9 |
| EC-no (EINECS/ELINCS/NLP) | 203-699-2 |
| PubChem | 8007 |
| ChEBI | 43799 |
| SMILES | CCCCN |
| InChI | 1S/C4H11N/c1-2-3-4-5/h2-5H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 73,137 g/mol |
| Teplota tání | −50 °C (223 K)[1] |
| Teplota varu | 78 °C (351 K)[1] |
| Hustota | 0,7327 g/cm3[1] |
| Rozpustnost ve vodě | neomezeně mísitelný[1] |
| Rozpustnost v polárních rozpouštědlech | mísitelný s ethanolem[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru[1] |
| Tlak páry | 10,9 kPa (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H302 H312 H314 H332[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P260 P261 P264 P270 P271 P280 P301+312 P301+330+331 P302+352 P303+361+353 P304+312 P304+340 P305+351+338 P310 P312 P321 P322 P330 P363 P370+378 P403+235 P405 P501[1] |
| Teplota vzplanutí | −1 °C (272 K)[1] |
| Teplota vznícení | 312 °C (585 K)[1] |
Některá data mohou pocházet z datové položky. | |
n-Butylamin je organická sloučenina patřící mezi aminy, se vzorcem CH3(CH2)3NH2.Jedná se o jeden ze čtyř izomerních primárních aminů odvozených od butanu, společně se sek-butylaminem, terc-butylaminem a isobutylaminem. Za standardních podmínek jde o kapalinu se zápachem podobným amoniaku, která je bezbarvá, při stání na vzduchu se ovšem zbarvuje do žluta.
Výroba a reakce[editovat | editovat zdroj]
Tato látka se vyrábí reakcí amoniaku s butan-1-olem za katalýzy oxidem hlinitým:
- CH3(CH2)3OH + NH3 → CH3(CH2)3NH2 + H2O
n-Butylamin je slabou zásadou, pKa [CH3(CH2)3NH3]+ je 10,78.[2]
Reaguje podobně jako jiné jednoduché alkylaminy, vstupuje například do alkylačních, acylačních a kondenzačních reakcí s karbonylovými sloučeninami. Vytváří komplexy s ionty kovů, například cis- a trans-[PtI2(NH2Bu)2].[3]
Použití[editovat | editovat zdroj]
N-butylamin se používá při výrobě některých pesticidů (například thiokarbazidů) léčiv a emulgátorů. Rovněž je prekurzorem N,N′-dibutylthiomočoviny, urychlovače vulkanizace kaučuku, a n-butylbenzensulfonamidu, používaného jako plastifikátor nylonu. Také se používá při výrobě fengabinu, fungicidů benomylu a butamoxanu a protidiabetického léku tolbutamidu.[4]

Bezpečnost[editovat | editovat zdroj]
LD50 n-butylaminu u krys při vstupu ústy je 366 mg/kg.[5]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku n-Butylamine na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m https://pubchem.ncbi.nlm.nih.gov/compound/8007
- ↑ H. K. Hall, Jr. Correlation of the Base Strengths of Amines. Journal of the American Chemical Society. 1957, s. 5441–5444. DOI 10.1021/ja01577a030.
- ↑ Fernande D. Rochon; Viorel Buculei. Multinuclear NMR Study and Crystal Structures of Complexes of the Types cis- and trans-Pt(amine)2I2. Inorganica Chimica Acta. 2004, s. 2218–2230. DOI 10.1016/j.ica.2003.10.039.
- ↑ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke, "Amines, Aliphatic" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.DOI:10.1002/14356007.a02_001
- ↑ n-Butylamine MSDS [online]. [cit. 2013-11-12]. Dostupné v archivu pořízeném z originálu dne 2013-11-12.
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu n-butylamin na Wikimedia Commons
Obrázky, zvuky či videa k tématu n-butylamin na Wikimedia Commons



