Fischerova projekce
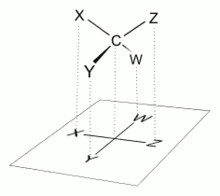

Fischerova projekce, navržená Hermannem Emilem Fischerem v roce 1891,[1][2] je způsob zobrazení čtyřvazného atomu uhlíku do roviny. Fischerova projekce se nejvíce hodí pro znázornění organických molekul s více chirálními centry a byla původně navržena pro zobrazování struktury sacharidů. Její využití pro zobrazení jiných tříd organických látek je možné (často se využívá například u aminokyselin), ale v některých případech je nevhodné a může být i zavádějící.[3] Fischerova projekce je symbolický způsob zobrazení chirálních sloučenin a jako taková jednoduše znázorňuje prostorové uspořádání molekuly a je vhodná pro porovnání stereoisomerů.
Způsob zobrazení[editovat | editovat zdroj]
Zobrazení organické molekuly ve Fischerově projekci spočívá v zakreslení chirálního atomu uhlíku do kříže, kde vodorovné čáry představují vazby vystupující před nákresnu a svislé čáry reprezentují vazby směřující za nákresnu.[4] Hlavní řetězec se vždy zakresluje svisle a skupina s nejvyšší prioritou se nachází nahoře. U aldos se tedy aldehydová skupina nachází zcela nahoře. U ketos, kde karbonylová skupina je obvykle na C-2, zakreslíme hlavní uhlíkatý řetězec tak, aby C-1 byl nahoře.[5]

Při zakreslení monosacharidu do Fischerovy projekce je zapotřebí zorientovat každý chirální uhlík přítomný v řetězci tak, aby vazby směřující k sousedním atomům uhlíku směřovaly za nákresnu, zbývající dva substituenty (vodík a hydroxyl) musí směřovat před nákresnu k pozorovateli.


Protože Fischerova projekce je symbolické znázornění organické molekuly, při porovnávání stereochemie dvou molekul jsou povoleny pouze některé operace s Fischerovou projekcí:
- Fischerova projekce může být v nákresně otočena o 180°, nikoliv o 90° nebo 270°.
- Je možné při zachování pozice jedné skupiny na chirálním centru otáčet zbývajícími třemi skupinami po směru otáčení hodinových ručiček.
Reference[editovat | editovat zdroj]
- ↑ Fischer, E., Ueber die Configuration des Traubenzuckers und seiner Isomeren. Berichte der deutschen chemischen Gesellschaft 1891, 24 (1), 1836-1845.
- ↑ Fischer, E., Ueber die Configuration des Traubenzuckers und seiner Isomeren. II. Berichte der deutschen chemischen Gesellschaft 1891, 24 (2), 2683-2687.
- ↑ Brecher, J., Graphical representation of stereochemical configuration (IUPAC Recommendations 2006). Pure Appl. Chem. 2006, 78 (10), 1897-1970. Dostupné online
- ↑ Moreno, L. F., Understanding Fischer Projection and Angular Line Representation Conversion. J. Chem. Educ. 2012, 89 (1), 175-176.
- ↑ McNaught, A. D., Nomenclature of carbohydrates (IUPAC Recommendations 1996). J. Carbohydr. Chem. 1997, 16 (8), 1191-1280. Dostupné online: web Archivováno 11. 8. 2011 na Wayback Machine., pdf Archivováno 22. 2. 2016 na Wayback Machine..
Literatura[editovat | editovat zdroj]
- McMurry, J. Organická chemie, 1. vydání; VŠCHT Praha: Praha, 2007. ISBN 978-80-7080-637-1.
- Wade Jr., L. G. Organic Chemistry (8th Edition), 8th ed.; Pearson, 2012. ISBN 978-0321768414.
Související články[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu Fischerova projekce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fischerova projekce na Wikimedia Commons
