Chlorid thiofosforylu
| Chlorid thiofosforylu | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | chlorid thiofosforylu |
| Ostatní názvy | thiofosforylchlorid, sulfochlorid fosforečný |
| Sumární vzorec | PSCl3 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 3982-91-0 |
| EC-no (EINECS/ELINCS/NLP) | 223-622-6 |
| PubChem | 19883 |
| SMILES | P(=S)(Cl)(Cl)Cl |
| InChI | 1S/Cl3PS/c1-4(2,3)5 |
| Vlastnosti | |
| Molární hmotnost | 169,40 g/mol |
| Teplota tání | -35 °C (238 K)[1] |
| Teplota varu | 125 °C (398 K)[1] |
| Hustota | 1,635 g/cm3[1] |
| Index lomu | 1,635[1] |
| Rozpustnost ve vodě | reaguje[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu, tetrachlormethanu a sirouhlíku[1] |
| Tlak páry | 2,9 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H314 H318 H335 H412[1] |
| P-věty | P260 P261 P264+265 P270 P271 P273 P280 P284 P301+317 P301+330+331 P302+361+354 P304+340 P305+354+338 P316 P317 P319 P320 P321 P330 P363 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Chlorid thiofosforylu je anorganická sloučenina se vzorcem PSCl3.[2] Jedná se o bezbarvou, na vzduchu dýmající kapalinu. Používá se na thiofosforylace organických sloučenin, například při výrobě insekticidů.
Příprava a výroba[editovat | editovat zdroj]
Chlorid thiofosforylu lze z chloridu fosforitého získat několika způsoby. V průmyslu se používá oxidace nadbytkem síry při teplotě 180 °C.[3]
- PCl3 + S → PSCl3
S pomocí katalyzátorů lze reakci provést i za nižších teplot. Přečišťování se provádí destilací.
Další možností je reakce sulfidu a chloridu fosforečného.[4]
- 3 PCl5 + P2S5 → 5 PSCl3
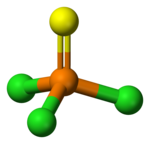
Struktura[editovat | editovat zdroj]
Chlorid thiofosforylu je tetraedrický a má molekulovou symetrii C3v. Délka vazby P=S je 189 pm a u vazby P–Cl činí 201 pm; úhel vazby Cl-P-Cl má velikost 102°.[5]
Reakce[editovat | editovat zdroj]
PSCl3 se rozpouští v benzenu, tetrachlormethanu, chloroformu, a sulfidu uhličitém.[2] V zásaditých roztocích a sloučeninách obsahující hydroxylové skupiny, jako jsou alkoholy, se hydrolyzuje za vzniku thiofosforečnanů.[3] S vodou tato látka reaguje, přičemž produkty se liší podle reakčních podmínek; může jít o kyselinu fosforečnou, sulfan a kyselinu chlorovodíkovou, nebo kyselinu dichlorthiofosforečnou a chlorovodíkovou.[6]
- PSCl3 + 4 H2O → H3PO4 + H2S + 3 HCl PSCl3 + H2O → HO-P(=S)Cl2 + HCl
PSCl3 se používá k navazování thiofosforylových skupin, P=S, na organické sloučeniny.[3] Tyto přeměny lze provést u aminů a alkoholů, a to i aminoalkoholů, diolů, a diaminů.[2] V průmyslu se chlorid tthiofosforylu používá na výrobu insekticidů, jako je například parathion.[6]
- PSCl3 + 2 CH3CH2OH → (CH3CH2-O-)2P(=S)-Cl + 2 HCl
- (CH3CH2-O-)2P(=S)-Cl + Na+[−O-C6H4-NO2] → (CH3CH2-O-)2P(=S)-O-C6H4-NO2 + NaCl
PSCl3 reaguje s terciárními amidy, přičemž se vytváří thioamidy.[2]:
- C6H5-C(=O)-N(-CH3)2 + PSCl3 → C6H5-C(=S)-N(-CH3)2 + POCl3
S methylmagnesiumjodidem vytváří tetramethyldifosfindisulfid, (H3C-)2P(=S)-P(=S)(-CH3)2.[7]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Thiophosphoryl chloride na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/19883
- ↑ a b c d Spilling, C. D. Thiophosphoryl Chloride, Encyclopedia of Reagents for Organic Synthesis John Wiley & Sons, Weinheim, 2001 DOI: 10.1002/047084289X.rt104
- ↑ a b c G. Betterman; W. Krause; G. Riess; T. Hofmann. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2005. ISBN 3527306730. DOI 10.1002/14356007.a19_527. Kapitola Phosphorus Compounds, Inorganic.
- ↑ Martin, D. R.; Duvall, W. M. “Phosphorus(V) Sulfochloride” Inorganic Syntheses, 1953, p73 DOI:10.1002/9780470132357.ch24
- ↑ Kuchitsu Kozo; Tohei Moritani; Yonezo Morino. Molecular structures of phosphoryl fluoride, phosphoryl chloride, and thiophosphoryl chloride studied by gas electron diffraction. Inorganic Chemistry. 1971, s. 344-350. DOI 10.1021/ic50096a025.
- ↑ a b Fee, D. C.; Gard, D. R.; Yang, C. “Phosphorus Compounds” Kirk-Othmer Encyclopedia of Chemical Technology John Wiley & Sons: New York, 2005 DOI:10.1002/0471238961.16081519060505.a01.pub2
- ↑ G. W. Parshall "Tetramethylbiphosphine Disulfide" Organic Syntheses 1965, volume 45, p. 102 DOI:10.15227/orgsyn.045.0102



