BODIPY
| BODIPY | |
|---|---|
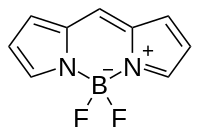 Strukturní vzorec | |
| Obecné | |
| Systematický název | 5,5-difluor-5H-4λ5-dipyrrolo[1,2-c:2′,1′-f][1,3,2]diazaborinin-4-ylium-5-uid |
| Sumární vzorec | C9H7BF2N2 |
| Vzhled | červené krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 138026-71-8 |
| PubChem | 25058173 |
| ChEBI | 51107 |
| SMILES | [B-]1(N2C=CC=C2C=C3[N+]1=CC=C3)(F)F |
| InChI | 1S/C9H7BF2N2/c11-10(12)13-5-1-3-8(13)7-9-4-2-6-14(9)10/h1-7H |
| Vlastnosti | |
| Molární hmotnost | 191,97 g/mol |
| Teplota tání | 450 °C (723,0 K)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v dichlormethanu[1] |
Některá data mohou pocházet z datové položky. | |

BODIPY je zkrácený název pro dipyrromethenbordifluorid, organickou sloučeninu, jejíž molekuly obsahují borodifluoridové funkční skupiny (BF2) napojené na dipyrromethenovou skupinu (C9H7N2), sloučeninu nazývanou 4,4-difluor-4-bora-3a,4a-diaza-s-indacen.[1] Jedná se o červenou pevnou látku, stálou při pokojové teplotě a rozpustnou v methanolu.[1] Příslušná výchozí sloučenina byla izolována v roce 2009,[2][1][3] ale deriváty odvozené náhradou jednoho nebo více vodíkových atomů jinými skupinami jsou známy již od roku 1968, a patří do skupiny označované jako BODIPY barviva.[4] Tyto organoborité sloučeniny jsou zkoumány jako fluorescenční barviva a jako značkovače v biologickém výzkumu.[1]
Struktura[editovat | editovat zdroj]
V krystalické podobě je molekula BODIPY téměř rovinná a symetrická; výjimku vytváříí dva atomy fluoru, nacházející se v rovině kolmé na zbytek molekuly.[1] Vazby lze popsat formálním záporným nábojem na atomu boru a kladným nábojem na jednom z dusíků.
Příprava[editovat | editovat zdroj]
BODIPY a jeho deriváty je možné připravit reakcemi příslušných 2,2'-dipyrromethenů s komplexem fluoridu boritého a diethyletheru za přítomnosti triethylaminu nebo 1,8-diazabicyklo[5.4.0]undec-7-enu (DBU).[1] Příprava je obtížná, protože dipyrromethenové prekurozry bývají mnohem méně stabilní než BODIPY.[1][5]
Dipyrrometheny se získávají, několika způsoby, z pyrrolů, obvykle takových, které mají na jednu z poloh alfa navázaný substituent. Kondenzacemi těchto pyrrolů, často dostupných prostřednictvím Knorrovy syntézy, s aromatickými aldehydy za přítomnosti kyseliny trifluoroctové se tvoří dipyrromethany, následně oxidované na dipyrrometheny pomocí chinonů, například 2,3-dichlor-5,6-dikyano-1,4-benzochinonu[1] nebo p-chloranilu.[6]
Další možností, jak získat dipyrrometheny, je vystavení pyrrolů aktivovaným derivátům karboxylových kyselin, obvykle acylchloridům. Nesymetrické dipyrrometheny mohou vznikat kondenzacemi pyrrolů s 2-acylpyrroly. Dipyrromethanové produkty se dají izolovat a přečistit, ale izolaci dipyrromethenů většinou ztěžuje jejich nestabilita.
Deriváty[editovat | editovat zdroj]


BODIPY vytváří mnoho různých derivátů, protože jej lze substituovat prostřednictvím pyrrolů, aldehydů i acylchloridů.[5]
Vodíkové atomy v pozicích 2 a 6 lze nahradit halogeny s použitím sukcinimidových činidel, například N-chlorsukcinimidu, N-bromsukcinimidu a N-jodsukcinimidu, které umožňují provádět další funkcionalizace párovacími reakcemi s boronovými estery nebo sloučeninami cínu.[5]
Dva atomy fluoru navázané na bor lze, během syntézy i po ní, nahradit silnějšími nukleofily, jako jsou alkynyl- a aryllithné sloučeniny,[5] chlor,[6] methoxyskupiny,[6] nebo dvojvazné substituenty.[9]
Reakci může katalyzovat BBr3 nebo SnCl4.[10]
Fluorescence[editovat | editovat zdroj]
BODIPY a jeho deriváty mají možné využití jako fluorescenční barviva. Silně absorbují ultrafialové záření a energii zpětně vyzařují v úzkém rozsahu frekvencí, většinou na vlnových délkách pod 600 nm. Polarita a pH prostředí na ně nemívají velký vliv a jsou dostatečně stálá za fyziologických podmínek. I malým pozměněním struktury je možné upravit jejich fluorescenční vlastnosti.[7] BODIPY barviva nejsou výrazně reaktivní. V roztocích je fluorescence slabší, což omezuje využití; tento nedostatek byl překonán vytvořením asymetrických komplexů boru a nahrazením fluorových skupin fenylovými.
Nesubstituované BODIPY má široký absorpční pás, mezi přibližně 420 a 520 nm s vrcholem na 503 nm a emisní pás mezi 480 a 580 nm s vrcholem na 512 nm, přičemž čas fluorescence činí 7,2 nanosekund. Fluorescence zaniká za teplot nad 50 °C.[2]
BODIPY barviva mají poměrně malé Stokesovy posuny, kvantové výtěžky nezávisí na prostředí, často se blížící 100 % i ve vodě a jsou dobře rozpustné v mnoha organických rozpouštědlech. Z těchto důvodů mají BODIPY fluorofory potenciál být používány v zobrazovacích metodách. Poloha absorpčních a emisních pásů se v různě polárních rozpouštědlech nemění.
Možná použití[editovat | editovat zdroj]
Komplexy BODIPY jsou zkoumány jako senzory a značkovače, protože jejich optoelektronické vlastnosti lze snadno ovládat.[11][12][13][14][15][16][17]
Odkazy[editovat | editovat zdroj]
Externí odkazy[editovat | editovat zdroj]
 Obrázky, zvuky či videa k tématu BODIPY na Wikimedia Commons
Obrázky, zvuky či videa k tématu BODIPY na Wikimedia Commons
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku BODIPY na anglické Wikipedii.
- ↑ a b c d e f g h i j k l K. Tram; H. Yan; H. A. Jenkins; S. Vassiliev; D. Bruce. The synthesis and crystal structure of unsubstituted 4,4-difluoro-4-bora-3a,4a-diaza-s-indacene (BODIPY). Dyes and Pigments. 2009, s. 392–395. DOI 10.1016/j.dyepig.2009.03.001.
- ↑ a b A. Schmitt; B. Hinkeldey; M. Wild; G. Jung. Synthesis of the Core Compound of the BODIPY Dye Class: 4,4′-Difluoro-4-bora-(3a,4a)-diaza-s-indacene. Journal of Fluorescence. 2009. DOI 10.1007/s10895-008-0446-7. PMID 19067126.
- ↑ I. J. Arroyo; R. Hu; G. Merino; B. Z. Tang; E. Peña-Cabrera. The Smallest and One of the Brightest. Efficient Preparation and Optical Description of the Parent Borondipyrromethene System. The Journal of Organic Chemistry. 2009, s. 5719–5722. DOI 10.1021/jo901014w. PMID 19572588.
- ↑ Alfred Treibs und Franz-Heinrich Kreuzer. Difluorboryl-Komplexe von Di- und Tripyrrylmethenen. Justus Liebigs Annalen der Chemie 1968, 718 (1): 208-223
- ↑ a b c d Kevin Burgess. BODIPY Dyes and Their Derivatives: Syntheses and Spectroscopic Properties. Chemical Reviews. 2007, s. 4891–4932. DOI 10.1021/cr078381n. PMID 17924696.
- ↑ a b c Brandon R. Groves; Sarah M. Crawford; Travis Lundrigan; Chérif F. Matta; Shahin Sowlati-Hashjin; Alison Thompson. Synthesis and characterisation of the unsubstituted dipyrrin and 4,4-dichloro-4-bora-3a,4a-diaza-s-indacene: Improved synthesis and functionalisation of the simplest BODIPY framework. Chemical Communications. 2013, s. 816–818. DOI 10.1039/c2cc37480c. PMID 23235887.
- ↑ a b Aurore Loudet and Kevin Burgess (2007): "BODIPY dyes and their derivatives: Syntheses and spectroscopic properties". Chemical Reviews, volume 107, issue 11, pages 4891–4932 DOI:10.1021/cr078381n
- ↑ Zhong-Hua Pan; Geng-Geng Luo; Jing-Wei Zhou; Jiu-Xu Xia; Kai Fang; Rui-Bo Wu. A simple BODIPY-aniline-based fluorescent chemosensor as multiple logic operations for the detection of pH and CO2 gas. Dalton Transactions. 2014, s. 8499–8507. DOI 10.1039/C4DT00395K. PMID 24756338.
- ↑ Patrycja Stachelek; Abdulrahman A. Alsimaree; Rua B. Alnoman; Anthony Harriman; Julian G. Knight. Thermally-Activated, Delayed Fluorescence in O,B,O- and N,B,O-Strapped Boron Dipyrromethene Derivatives. The Journal of Physical Chemistry A. 2017-03-16, s. 2096–2107. ISSN 1089-5639. DOI 10.1021/acs.jpca.6b11131. PMID 28245114. Bibcode 2017JPCA..121.2096S.
- ↑ Dumitru Sirbu; Andrew C. Benniston; Anthony Harriman. One-Pot Synthesis of a Mono-O,B,N-strapped BODIPY Derivative Displaying Bright Fluorescence in the Solid State. Organic Letters. 2017-04-07, s. 1626–1629. ISSN 1523-7060. DOI 10.1021/acs.orglett.7b00435. PMID 28319396.
- ↑ Dumitru Sirbu; Saimir Luli; Jack Leslie; Fiona Oakley; Andrew C. Benniston. Enhanced in vivo Optical Imaging of the Inflammatory Response to Acute Liver Injury in C57BL/6 Mice Using a Highly Bright Near-Infrared BODIPY Dye. ChemMedChem. 2019-05-17, s. 995–999. ISSN 1860-7179. PMID 30920173.
- ↑ Toshiyuki Kowada; Hiroki Maeda; Kazuya Kikuchi. BODIPY-based probes for the fluorescence imaging of biomolecules in living cells. Chemical Society Reviews. 2015, s. 4953–4972. DOI 10.1039/C5CS00030K. PMID 25801415.
- ↑ Yong Ni; Jishan Wu. Far-red and near infrared BODIPY dyes: Synthesis and applications for fluorescent pH probes and bio-imaging. Organic & Biomolecular Chemistry. 2014, s. 3774–3791. DOI 10.1039/c3ob42554a. PMID 24781214.
- ↑ Heidi Abrahamse; Michael R. Hamblin. New photosensitizers for photodynamic therapy. Biochemical Journal. 2016, s. 347–364. DOI 10.1042/BJ20150942. PMID 26862179.
- ↑ Hua Lu; John Mack; Yongchao Yang; Zhen Shen. Structural modification strategies for the rational design of red/NIR region BODIPYs. Chemical Society Reviews. 2014, s. 4778–4823. DOI 10.1039/C4CS00030G. PMID 24733589.
- ↑ Jean Roncali. Molecular Bulk Heterojunctions: An Emerging Approach to Organic Solar Cells. Accounts of Chemical Research. 2009, s. 1719–1730. DOI 10.1021/ar900041b. PMID 19580313.
- ↑ Ha Na Kim; Wen Xiu Ren; Jong Seung Kim; Juyoung Yoon. Fluorescent and colorimetric sensors for detection of lead, cadmium, and mercury ions. Chemical Society Reviews. 2012, s. 3210–3244. DOI 10.1039/C1CS15245A. PMID 22184584.

